多次被FDA拒绝,现在发起公民请愿书
近日,BrainStorm Cell Therapeutics又一次向监管机构发起了冲锋。这家在2022年就已经资金紧张的公司如今试图用ALS社区的公民请愿书来获得FDA的批准。
现在的BrainStorm可以说是财务状况岌岌可危,2024年至今公司现金流一直在一百万美元左右徘徊,虽说公司表示只要有资金支持就能推动临床,但现有资金恐怕不足以推进新的临床试验,这一次尝试对于公司来说举足关键。
审批历程
事件的核心是BrainStorm最关键的管线NurOwn(又名MSC-NTF),这是一种自体间充质干细胞疗法,源于患者自身骨髓的间充质干细胞(MSC),这些细胞在体外经定向分化为可以分泌高水平神经营养因子(NTF)的MSC-NTF细胞。经修饰后的MSC-NTF细胞再回输到患者体内,可以有效地将多种NTF和免疫调节细胞因子直接递送至损伤部位,从而引起所需的生物学效应,并最终减缓或稳定疾病的进展。
BrainStorm最初的尝试始于2020年11月,BrainStorm首次向FDA提交NurOwn的生物制品许可申请(BLA),基于一项III期临床试验(NCT03280056),该试验招募约200名ALS患者,随机1:1接受NurOwn或安慰剂,主要终点为ALS功能评分量表(ALSFRS-R)变化。试验的主要终点和关键次要终点均未达到。33%的MSC-NTF组患者和28%的安慰剂组患者达到临床响应指标,两组之间没有显著差异。
不出意外,次年3月,FDA就拒绝批准,认为试验数据未达到主要终点和关键次要终点,无统计学意义。
尽管没有达到统计学上意义上的差异,但在接受MSC-NTF治疗的ALS患者中观察到神经炎症、神经变性和神经保护相关的脑脊液生物标记物的显著改善,公司仍对其抱有希望。
后续的临床数据分析显示,MSC-NTF疗法可能对一部分病情较轻的患者有益。
2022年8月,BrainStorm修正数据后二次提交BLA,但次要终点(如脑脊液生物标志物)仍无显著差异。3个月后,FDA再次发出拒绝提交(RTF)信函,再次否决申请。
2023年3月,BrainStorm通过抗议提交程序第三次提交BLA,FDA恢复审查,PDUFA目标日期定为2023年12月8日。
2023年9月27日,FDA细胞、组织和基因疗法咨询委员会以17:1反对批准,认定有效证据不足。似乎是看到了获批可能性不大,BrainStorm干脆在11月宣布撤回BLA,转而推进IIIb期试验。
转机
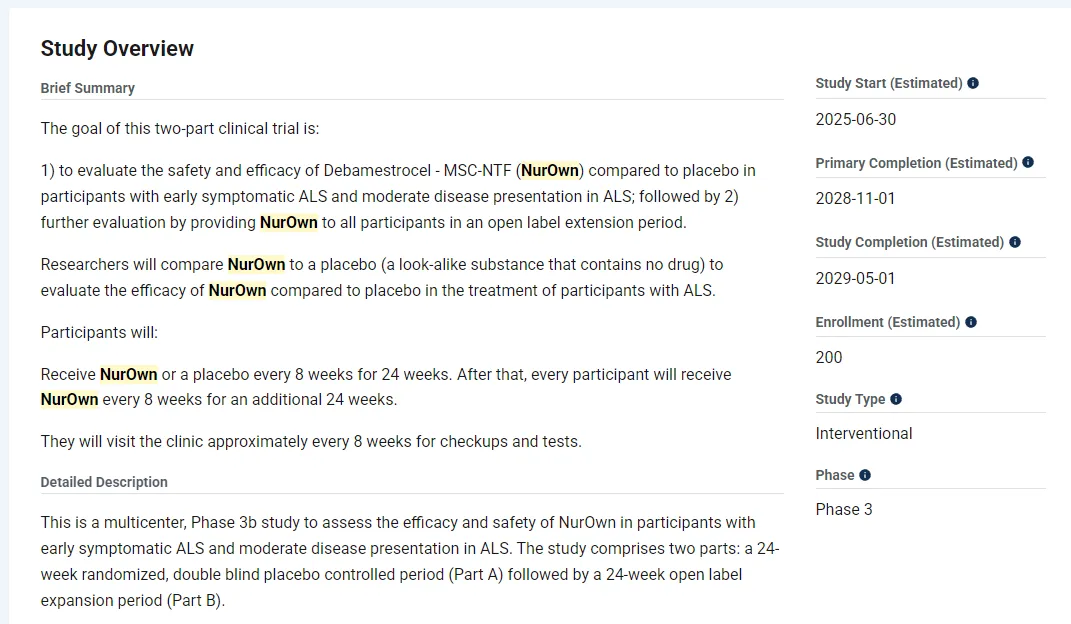
2023年12月FDA倒是给了BrainStorm一个机会,双方达成协议,BrainStorm会推进针对早期ALS患者的IIIb期试验。该试验采用特殊方案评估(SPA),若数据达标,FDA承诺批准。这种模式为公司提供了明确的监管路径。
尽管与FDA就IIIb期试验的推进路径达成一致,但是临床到2025年的现在似乎都没有开展,ClinicalTrials.gov虽然显示为今年6月30日展开,但是BrainStorm方面表示推迟了。这大概是因为BrainStorm确实没什么钱了,公司方面也表示钱到位了,试验就会立即启动。
不过就算试验完成了,那预计也要等到2029年,公司能不能活下去还是个问题。
而另外一方面,BrainStorm长期坚持认为,III期临床的失利是由于临床终点的测量表设置不能捕捉一部分患者病情严重程度的变化。
而就在上个月,BrainStorm又在新闻稿中披露,10名在试验后进入NurOwn扩展访问计划(EAP)的患者中,有9人自ALS症状出现后存活超过5年。公司指出,根据其他已发表数据,约10%的ALS患者能存活超过5年,而EAP患者的中位生存期为症状出现后6.8年。
这也是现在ALS社区发动公民请愿书的根据,患者请愿书代表表示III期试验和EAP数据包括“100%五年生存率对比ALS自然病史的高20%”,以及“接受NurOwn治疗后无进展生存期(PFS)延长数月至17个月不等”。这些数据记录的变化“在ALS临床试验史上前所未有”。
如果BrainStorm所言为真,这或许对于这家公司来说真是一个转机。
不过,这还是需要BrainStorm向FDA提供足够具有信服力的数据,BrainStorm真的能如愿吗?
*声明:本文内容转载于网络,版权归原作者所有,转载目的在于传递信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除!
(https://mp.weixin.qq.com/s/uGmTiWx56aY9bT3nZIsx9g)



