近年来,药物研发新概念、新技术层出不穷。
在小分子领域,靶向蛋白质降解技术吸引力了众多药企的关注。公开资料显示,包括辉瑞、百时美施贵宝、诺华等跨国大药企,以及百济神州、海思科、开拓药业等许多国内药企都在进行这一创新疗法的开发。那么,靶向蛋白降解技术是什么?有何特点?国内外正在开发的蛋白降解剂有哪些?
1. 靶向蛋白质降解起源
追溯靶向蛋白质降解剂的源头,可以从1991年前哈佛大学的施莱伯教授(Stuart Schreiber)把环孢素A和FK506这类诱导两个蛋白质相互作用的大环类小分子做分子胶(molecular glue)算起。
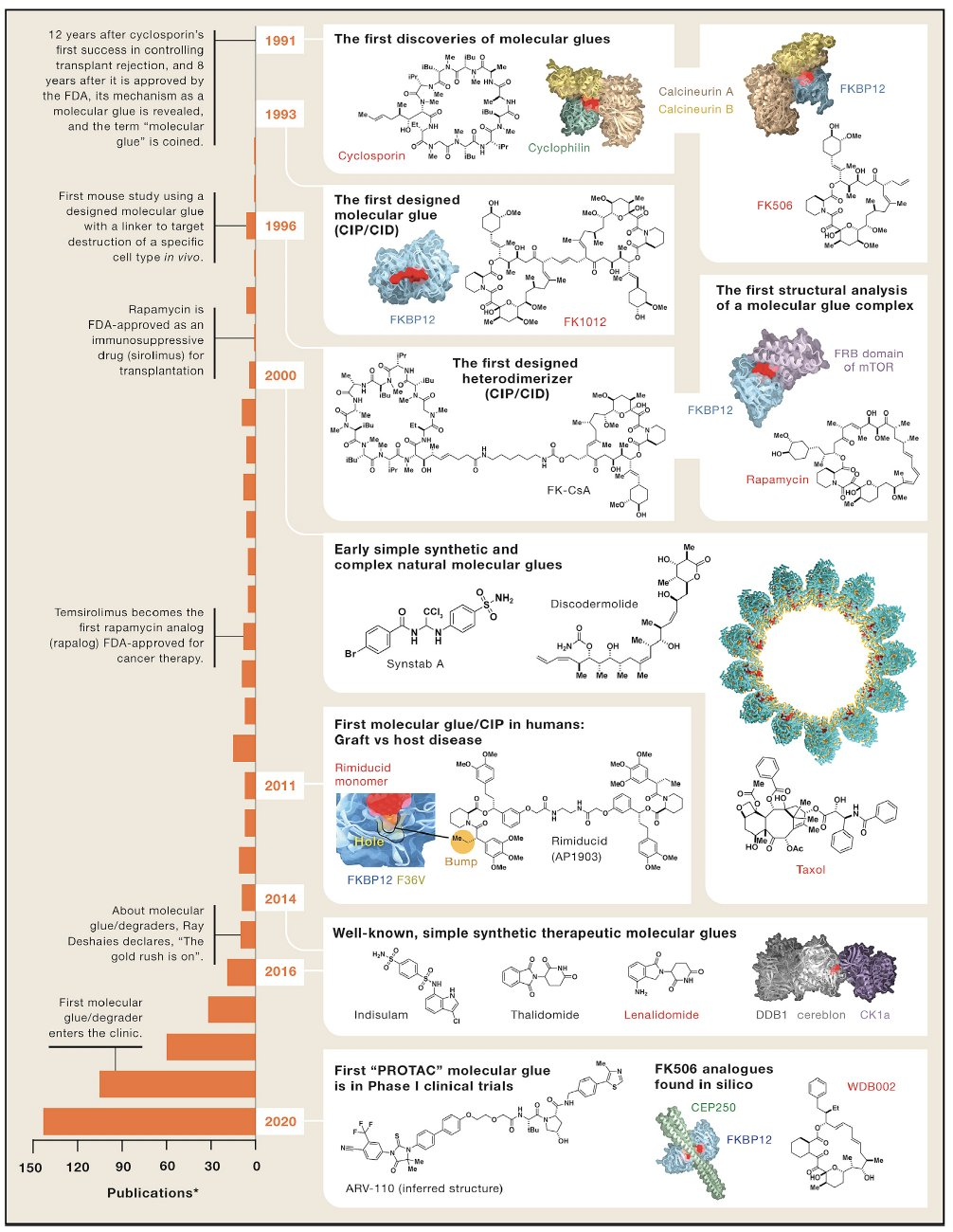
图 1 分子胶发展历程 图源:Cell综述分子胶水的兴起
分子胶的机理其实就是诱导蛋白降解(Induced protein degradation)实际上不是什么新概念。
临床上很多药物,意外发现具有降解靶蛋白的作用:比如治疗乳腺癌的药物氟维司群(Fulvestrant)和他莫昔芬(Tamoxifen)可以降解雌激素受体;来那多胺可以特异性降解转录因子IKZF1和IKZF3。阿斯利康的EGFR抑制剂奥希替尼(Osimertinib, AZD9291),临床上比其他T790M抑制剂疗效更好,也有证据表明,是因为它不但抑制酶活性,也选择性诱导EGFR T790M的降解。
但分子胶的发现和设计往往可遇不可求,不具有普适性很难进行模块化设计。而且随后2001年,在施莱伯教授实验室做过博士后研究的克鲁斯教授(Craig Crews)和德沙伊斯教授(Ray Deshaies)一起提出了可以模块化合成的双功能降解激活化合物PROTAC的概念。
2001 年报道了第一个人工设计合成的Protac-1。一端是多肽,作为E3连接酶的配体;另一端是靶蛋白MetAP-2配体,血管生成抑制剂ovalicin,利用“两手抓两个蛋白来靠近”,把靶蛋白MetAP-2招募到E3连接酶上,实现泛素化和蛋白酶体降解。Protac-1 成功充当了媒人,而且一旦完成这一桩婚事,还可以继续寻找下一对蛋白进行撮合,从而展现出这类分子和传统抑制剂药物的最大不同,催化剂效应导致更低浓度即可更持久的起效。
随后发现了一种来自HIF1α的多肽,它与 E3 连接酶肿瘤抑制因子 (VHL)结合,导致设计可以穿透细胞的PROTAC成为可能。
从技术上讲,这些早期的 PROTAC 现在被认为是“生物大分子PROTAC”,因为它们不是完全的小分子结构,而是包含 E3 连接酶的肽配体。但基于这些早期研究,打开了小分子PROTAC的合理设计之门。
2. 降解剂靶点最新研究进展
20年间,以PROTAC为代表的蛋白质降解技术已从学术界转移到工业界,多家生物技术和制药公司已经披露了临床前和早期临床开发项目。
耶鲁大学的克鲁斯创办了Arvinas,该公司与辉瑞,默克,基因泰克和拜耳等制药巨头都建立了合作关系。
另一家蛋白质降解剂公司C4 Therapeutics把分子胶和PROTAC按功能划分,分别叫做MonoDAC和DiDAC。前者是单功能降解激活化合物,它通过与E3泛素连接酶结合并在其上产生“胶水”来增强E3与靶蛋白的结合效力,这类化合物能够降解不可接近的靶蛋白,即分子胶降解剂;而后者是双功能降解激活化合物,其设计使降解分子的一端与致病靶蛋白结合,另一端与E3连接酶结合,BiDAC也被称为“异双功能降解剂”,也就是PROTAC。与MonoDAC相比,BiDAC由于有3个部分组成,因此分子量较大,这两种降解剂各具优势,在应用场景上能够做到强力互补。
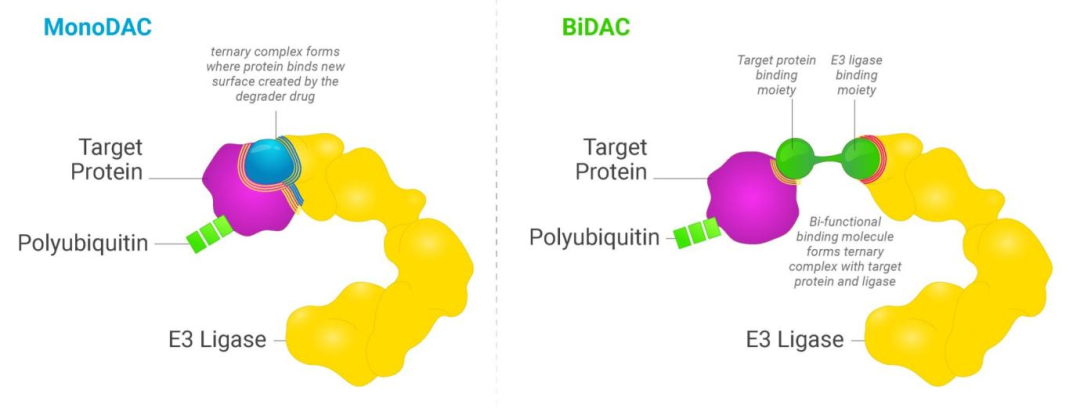
图5 MonoDAC 降解剂和 BiDAC 降解剂机理示意图 图源:C4 Therapeutic官网
降解剂的开发不同于传统抑制剂来温柔的控制引起疾病的蛋白质,而是通过将蛋白质目标引入蛋白酶体(细胞的垃圾处理系统)来粉碎它们。这种方法可以有效地对抗目前无法成药的靶点蛋白。
那么有哪些蛋白质靶点应该优先考虑降解剂开发?参考最近的文献已知可被降解的靶标蛋白包括:
◆ 激酶类:RIPK2、BCR-ABL、EGFR、HER2、c-Met、TBK1、CDKs、ALK、Akt、CK2、ERK1/2、FLT3、PI3K、BTK、Fak等。
很多激酶抑制剂都会使用二氨基嘧啶作为母核。但这也导致了靶点选择性比较差,经常对其他很多激酶都有很强的抑制活性,传统激酶抑制剂药物开发过程中脱靶效应常常成为毒副作用的主要来源,影响新药开发的成功率。
作为激酶研究领域的大牛,格雷 (Nathanael Gray)教授团队基于二氨基嘧啶骨架合成的PROTAC虽然能够结合190多种激酶,但是细胞实验中只降解了数十种激酶,大大提高了靶点的选择性。
◆ BET蛋白:BRD2/4/6/9
王少萌教授团队发现的QCA570在细胞抗增殖活性方面表现出了明显优于JQ1等抑制剂的能力,JQ1等抑制剂的活性大都在纳摩尔级水平,而QCA570的活性达到了惊人的皮摩尔级水平。降解剂在体内也表现出了强效抗肿瘤活性,而且呈现出给药剂量低和给药频次也低的特点。这说明在类似BET等靶点中,PROTAC具有明显的优势。
不过,BRD4的降解剂在推向临床试验中并不顺利,C4 Therapeutics公司和Arvinas公司针对BRD4的PROTAC管线因为这个靶点本身的毒副作用都被放弃或暂停,但好消息今年5月C4 Therapeutics开发的针对BRD9口服降解剂抗癌药进入一期临床。

图 8 图源:王少萌教授课题组论文 J. Med. Chem. 2018, 61, 15, 6685–6704
◆ 核受体蛋白:AR、ER等
AR降解剂ARV-110是一种针对雄激素受体(AR)的PROTAC蛋白质降解剂,所以AR活性是前列腺癌的关键驱动因素,调节AR信号的能力是控制疾病进展的重要因素。ARV-766也是一款靶向雄激素受体(AR),但与ARV-110拥有不同特征,目前该药物正处于1期临床试验。初步试验数据显示,ARV-110在剂量达420毫克时耐受性良好。
ER降解剂ARV471作为ER+/HER2−局部晚期或转移性乳腺癌患者的单一疗法进入临床试验。ARV-471的中期数据显示了不错的耐受性,优秀的临床疗效,临床受益率为42%,与氟维司群这类选择性雌激素受体降解剂 (SERD)相比,ARV-471效果更好。该药物目前处于2期临床试验中。在未来的研究中,Arvinas打算将ARV-471作为单一药物与CDK4/6抑制剂等其他疗法联合使用。
◆ 其他药物靶点:EGFR、NF-κB、EGFR、NF-κB、ARNT、PCAF/GCN5、Tau、FRS2、EZH2等
耶鲁大学的克鲁斯团队、西奈山医学院的金坚教授,上海有机所丁克教授,西安交大张三齐教授和哈佛大学格雷教授等课题组都有靶向EGFR的降解剂的研究,希望通过蛋白降解方式克服传统小分子药物耐药突变。其中,格雷课题组将变构抑制剂也应用到了PROTAC当中,提高活性的同时也具有优秀的选择性避免对野生型蛋白的降解。
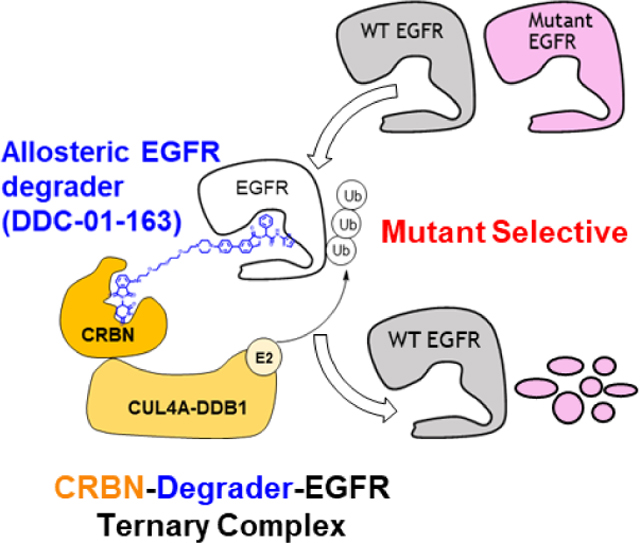
图 9 通过变构机制靶向表皮生长因子受体 (EGFR) 提供了一种潜在的治疗策略来克服 ATP 结合位点内出现的耐药性 EGFR 突变。
图源:格雷教授课题组论文 Angewandte Chemie 132.34 (2020): 14589-14597.
张三齐团队对共价EGFR配体进行改造,发现了靶向降解EGFR突变体的强力PROTAC分子CP17。
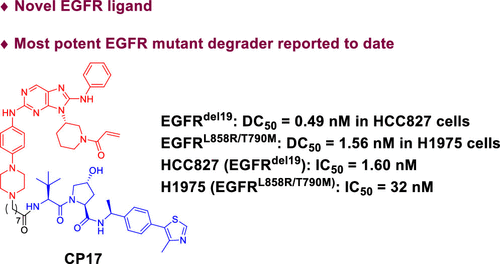
图 10 图源:张三齐教授课题组论文 J. Med. Chem. 2022, 65, 6, 4709–4726
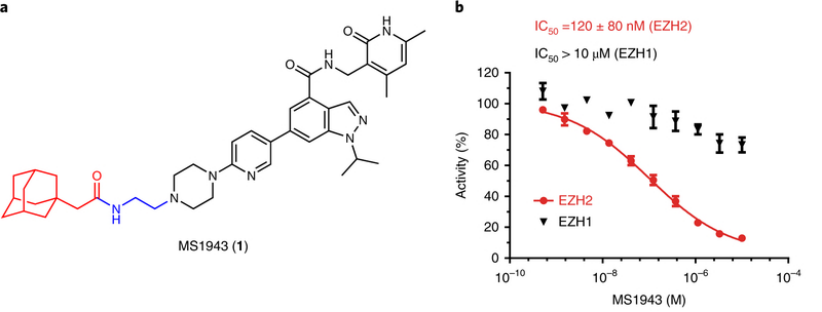
图 11 MS1943,一种组蛋白甲基转移酶 EZH2 选择性降解剂。
图源:金坚教授课题组论文 Nature chemical biology, 16(2), 214-222.
西奈山伊坎医学院的表观基因抑制剂专家金坚教授团队在Nature子刊发表了EZH2选择性降解剂MS1943的研究成果,这款小分子的设计借鉴了疏水性标签HyT技术,即类似于Fulvestrant诱导的表面疏水性,该方法将疏水性部分(比如金刚烷)附加到靶蛋白的表面上,模拟部分未折叠的蛋白状态,并利用胞质未折叠蛋白响应系统来降解靶标。三阴性乳腺癌细胞中显示出用出色的活性,同时对正常细胞无害。此外,该化合物显示出较高的口服生物利用度,可能是由于与大多数 PROTAC 相比,该分子的尺寸更小。
3. 国内外靶向蛋白降解剂领域药物研发进展
根据公开数据库,截至到2022年5月,共有5个分子胶药物和19个PROTAC药物已经进入临床阶段,靶点包括AR、ER、BCL-XL、IRAK4、STAT3、BTK、TRK和BRD9等。
国内外进入临床阶段的蛋白质降解药物在研管线
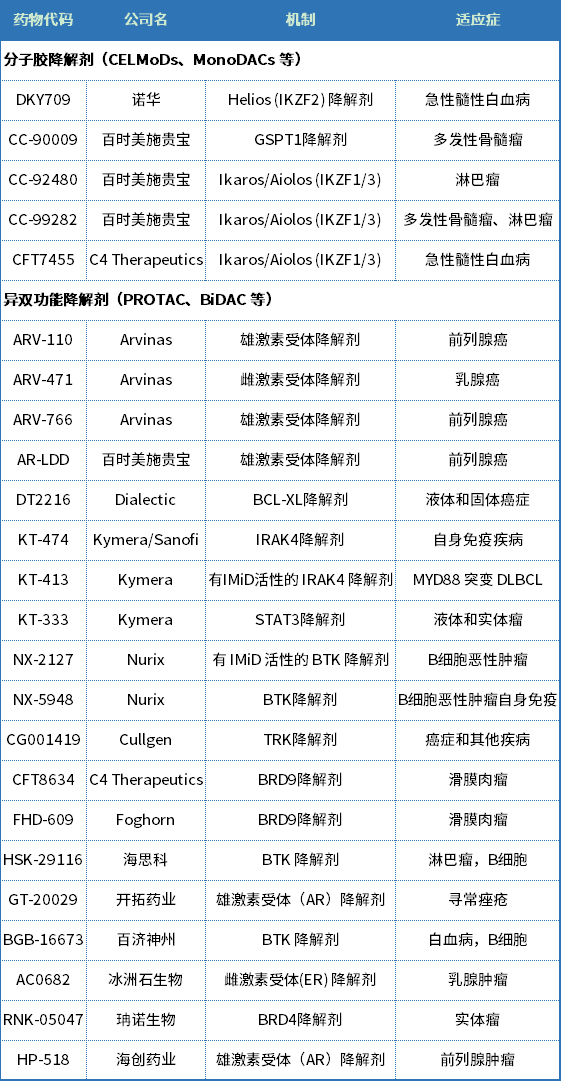
资料来源:Pharmacodia数据库和Nature Reviews Drug Discovery论文
其中值得关注的一个靶点:Irak4。辉瑞公司悄悄停止了IRAK4抑制剂PF-06650833的开发。Kymera 公司的KT-474项目由于是针对同一靶点的PROTAC,受到负面影响其股价下跌了 24%;最近Kymera 公司宣布修改KT-474的临床1期方案,将剂量从 14 天增加到 28 天。
临床开发中的 Irak-4 项目

资料来源:EvaluatePharma新闻和Clinicaltrials.gov
4. 蛋白质降解技术挑战和展望
分子胶的缺点是很难理性设计分子,针对选定的疾病相关靶标进行降解。毒副作用是PROTAC发展的另一个瓶颈。存在潜在的靶向和非靶向副作用。
除此之外靶标蛋白受限,比如跨膜蛋白可能不是PROTAC的正确靶点,不过溶酶体靶向嵌合体(LYTACs)和,自噬靶向嵌合体(AUTACs)可能可以解决这个问题。去年Lycia Therapeutics与礼来公司达成合作,他们的溶酶体靶向嵌合体(LYTAC)蛋白降解技术能将细胞外蛋白送至溶酶体中进行降解。
最近发表在Nature Reviews Drug Discovery杂志上的一篇Perspective中,来自英国的一个科学家团队提出了一个系统的方法来评估蛋白质靶点的可PROTAC性(PROTACtability)。利用这一方法,他们鉴定出了1 067种尚未在文献中被报道的PROTAC靶点,这为基于PROTAC的药物研发提供了潜在的新机会。
最后提出一些值得思考问题和读者交流:
参考文献:
1.Cell综述:分子胶水的兴起
http://fanpusci.blog.caixin.com/archives/241738
2.Nature综述:PROTAC过去只是序幕
https://www.nature.com/articles/s41573-021-00371-6
3. IRAK4靶向药物的摇摆
https://www.evaluate.com/vantage/articles/news/snippets/irak-4-approach-has-wobble
 |手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033
|手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033