欢迎您注册蒲公英
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
文章来源:微信公众号博药:微信号ID:PortonMKT
探索催化剂以促进和完善反应性是有机化学的一项中心工作。 在过去,人工催化剂已经取得了令人瞩目的发展,利用特定元素,可以进行无数种反应。这些催化剂用途广泛,但其速率和选择性与酶却无法相提并论。为了兼具酶催化与人工催化的优势,生物催化应运而生,正在成为一个跨学科的领域。
1. 生物催化:鱼与熊掌皆可得也 生物催化需要化学家和蛋白质工程师之间相互合作,在大自然的帮助下,来弥合两种催化方式之间距离。目前,生物催化已取得了令人印象深刻的成绩,包括建立新的化学转化。 诺贝尔化学奖得主Frances H. Arnold 教授发表于nature synthesis的评论性文章总结了新于自然(new-to-nature)生物催化研究进展,重点介绍了若干跨学科研究的例子,这些研究将有助于扩大生物催化的范围,包括通过生物仿生学的视角探索的酶的多功能性概念,以实现超越目前化学催化所能实现的活性和选择性。

2. 仿生催化:合成化学与酶催化的第一次碰撞 仿生催化,即开发寻求模仿生命反应和模仿酶底物活化的人造催化剂,是合成化学和酶催化之间许多重要合作的第一个,起源于20世纪50年代。尽管它无法重现酶的快速速率和无与伦比的选择性,但生物仿生学推动了合成化学的进步,包括开发自然界尚不知道的催化反应。 在细胞色素P450单氧酶的故事中,可以看出生物学和化学相互启发、相互借鉴和相互促进的卓越方式。 自20世纪60年代发现以来,含血红素的P450酶有选择地用分子氧氧化特定的C-H键的惊人能力,吸引了更广泛的化学界的注意。Breslow和Gellman在1982年证明,铁四苯基卟啉复合物可以接受氮宾前体,并有能力进行C-H胺化反应(图1a)。三年后,他们又与Svastits和Dawson合作,证明了兔肝微粒体细胞色素P450-LM3,4可以接受亚硝酸盐前体作为底物,进行C-H胺化反应(图1b)。 虽然活性太低,在合成上没有用处(观察到分子内磺酰胺化的总周转次数(TTN)为2.2),但这一研究思路提供了两个关键的见解:酶可以进行其自然范围之外的反应,化学家可以利用他们的知识从自然界的催化机制中发现新的化学。
 图1:用于C-H插入反应的仿生和酶促的氮宾转移。(图片来源:nature synthesis)
3. 定向进化:改进酶的特性 下一步,将微量的生物活性细化为强大的催化作用,将需要蛋白质工程来训练酶以其标志性的速率和选择性来进行新的反应。 约翰.梅纳德.史密斯(John Maynard Smith)在其1970年的经典著作《自然选择和蛋白质空间的概念》中提供了一个理论基础,说明在一个既广阔又大多没有功能序列的序列空间中,通过自然选择进行蛋白质进化在操作上是可能的。当单一突变积累到一定程度时,酶便可朝着目标方向进化。这为人工实现酶的定向进化提供了理论基础。 自从20世纪90年代初首次展示以来,定向进化已经成为一种可靠的策略,用于设计具有改进特性的酶,如热稳定性、耐受有机共溶剂的能力、催化效率、增加底物耐受性和其他许多特性。 但是新的反应性呢?当时并不清楚这样一个保守的过程如何能产生催化新反应的酶,但是,人们了解到自然界为特定转化而选择的酶也可能显示出其他的活性。虽然一个酶的生物功能可能是自然选择的产物,但它的其他活性是不受选择压力限制的。当其他活性变得有益,自然选择可能会产生一种以该功能为主的新酶。这样的话,通过人类强加的条件、非自然的反应物或人工蛋白质修饰,这些在自然界中无法获得或不相关的东西可能会显示出自然界中从未见过的杂交活性。只要能够确定一种能够进行所需的新的自然转化的酶,就应该有可能指导它的进化,将低产、杂乱无章的酶的活性细化为强大而高效的生物催化。 在Breslow和Gellman最初对酶促氮宾转移的研究近三十年后,工程酶现在可以进行高立体选择性的C-H胺化反应,TTN值为数百至数千(图1c)。仿生铁卟啉催化剂和血红蛋白之间的机制类比导致了这些蛋白质支持的其他非天然反应性的发现,如碳烯转移,甚至没有天然酶功能的血红蛋白(例如球蛋白和细胞色素c)也被设计成具有生物碳烯转移活性(图2a)。通过这种方式发现的反应包括一些用化学催化方法没有观察到的反应,如从炔烃中形成双环丁烷。 富有想象力的化学家现在已经开始发现,当一个蛋白质被提供给非天然反应物、外部刺激或其他生物成分时,可以支持其他混杂的活性。除了上面讨论的血蛋白催化的碳化物和亚硝酸盐转移外,还有两个明显的例子说明了这种创造性的工作(图2)。
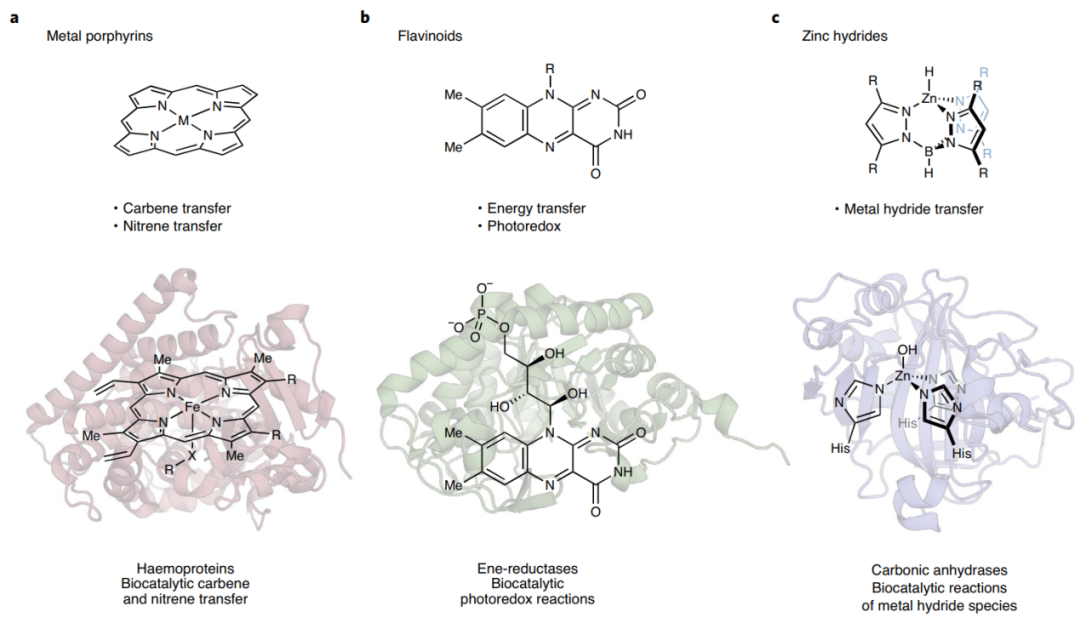 图2:具有新于自然的反应模式的生物反应的辅助因子适应性的代表例子。(图片来源:nature synthesis) 通过定向进化,进一步改善酶的参数和性能,以及底物范围是可能的。酶固有的机制多样性与蛋白质工程相结合,为发现新的生物催化剂提供了巨大的潜力。 一些关于新于自然的生物催化转化的报告突出了自然界、合成化学和蛋白质工程之间的这种合作努力的潜力,以克服长期的合成挑战(图3)。
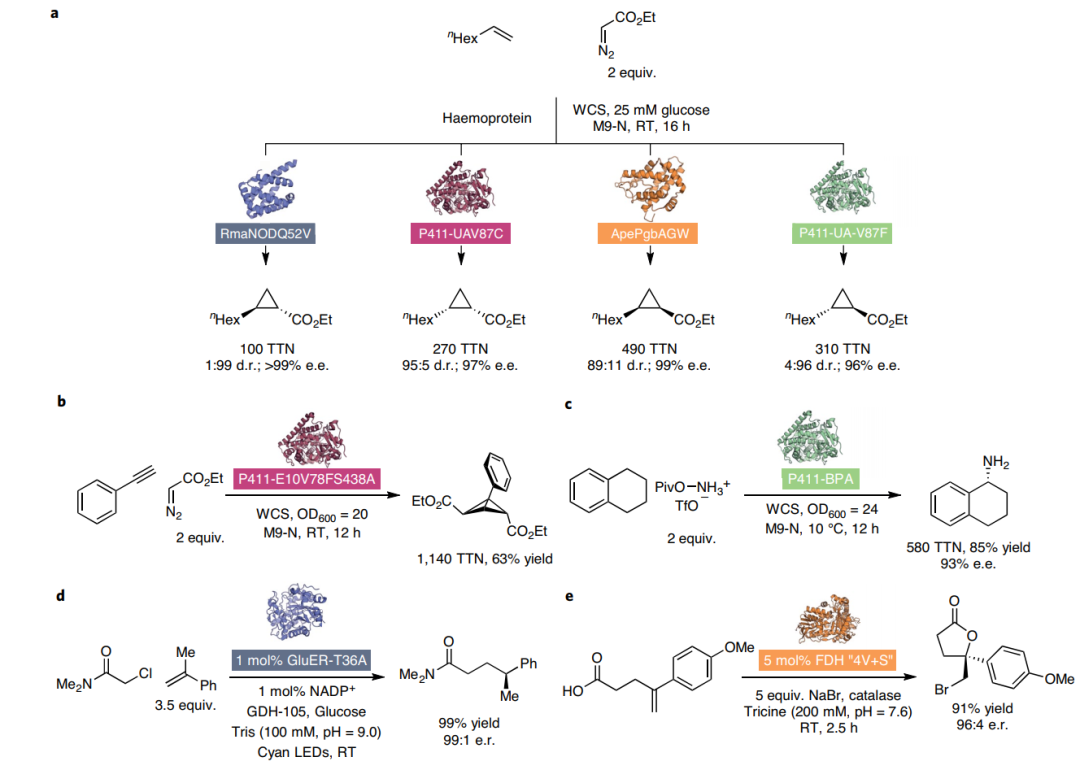 图3:New-to-nature的酶催化作用的部分例子。(图片来源:nature synthesis)
4. 蛋白质设计:促进生物催化发展的另一面 与上面讨论的化学方面的进展一道,蛋白质设计能力方面的进展也促进了新的生物化学的发现。计算模型是实现这一目标的有用工具,以设计新的酶为目标的蛋白质模型在过去20年中受到了极大的关注。2008年,Röthlisberger等人通过计算设计了一种催化非生物坎普消解的酶,并且改进了最低性能设计以表现出改进的活性。自该报告以来,其他的酶也被计算设计用于自然界中代表性有限的反应,包括Diels-Alderases和Morita-Bayliss-Hillmanases。 由于研究人员对问题的理解有限,所以从头设计的酶的初始活性往往很低,但定向进化可以挽救不良的设计,以实现更接近天然酶的速率和选择性。 计算设计还可以指导对已知酶功能的扩展。例如,作为开发合成西格列汀的生物催化工艺路线的一部分,默克公司的研究人员对转氨酶活性部位进行了计算性的重新设计,以接受前西格列汀酮,为定向进化活动提供了一个关键起点。大量可靠地模拟蛋白质以从头生成新酶和重新设计现有酶的方法对于生物催化来说是非常宝贵的。
5. 展望 展望未来,利用计算蛋白质设计、下一代测序和机器学习的蛋白质工程新工具将加速我们设计具有新活性的酶的能力。定向进化在本质上是不可知的,它经常通过远离活性部位的微妙的有益突变来改善酶的性能,这对化学家和蛋白质工程师来说是不直观的。然而,这种变化的效果可以通过从数据中学习的计算机算法来预测。机器学习工具已经使蛋白质结构能够以更大的可靠性从序列中预测出来;将工程序列与功能相关联将是下一个重大挑战。 总之,生物催化是合成化学家、蛋白质工程师和大自然之间持续而富有成效的合作。科学家们目前还只触及到酶所能实现的化学转化的表面,生物学带来的无限惊喜、蛋白质工程技术的日益强大和复杂以及持续的化学智慧将继续推动生物催化的创新。
参考文献 Miller D C, Athavale S V, Arnold F H. Combining chemistry and protein engineering for new-to-nature biocatalysis[J]. Nature Synthesis, 2022, 1(1): 18-23.
|  |手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033
|手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033