欢迎您注册蒲公英
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
本帖最后由 孙艳红 于 2025-3-12 16:01 编辑
最近我们的专家团队在执行API审计时,客户提出了普遍困扰行业的问题:

在针对这些问题进行检索后,我们发现,小伙伴们对于API生产日期制定的理解存在较大分歧,缺乏统一的认识。即便是功能强大的DeepSeek,也仅仅提供了一些基本原则,缺乏具体的操作建议,导致许多小伙伴真正实施时仍然感到无从下手。 
那么,API的“生产日期”究竟如何制定才合理呢?
接下来,我们将逐步深入探讨,逐一解答以上问题。
01 API定义
上述的原料药是指化学药品制剂的原料(中国GMP 2010第三十五条规定)。 
02 常见的API生产工序
在探讨生产日期之前,我们首先需要了解API的典型生产工序。以下是常见的生产流程: 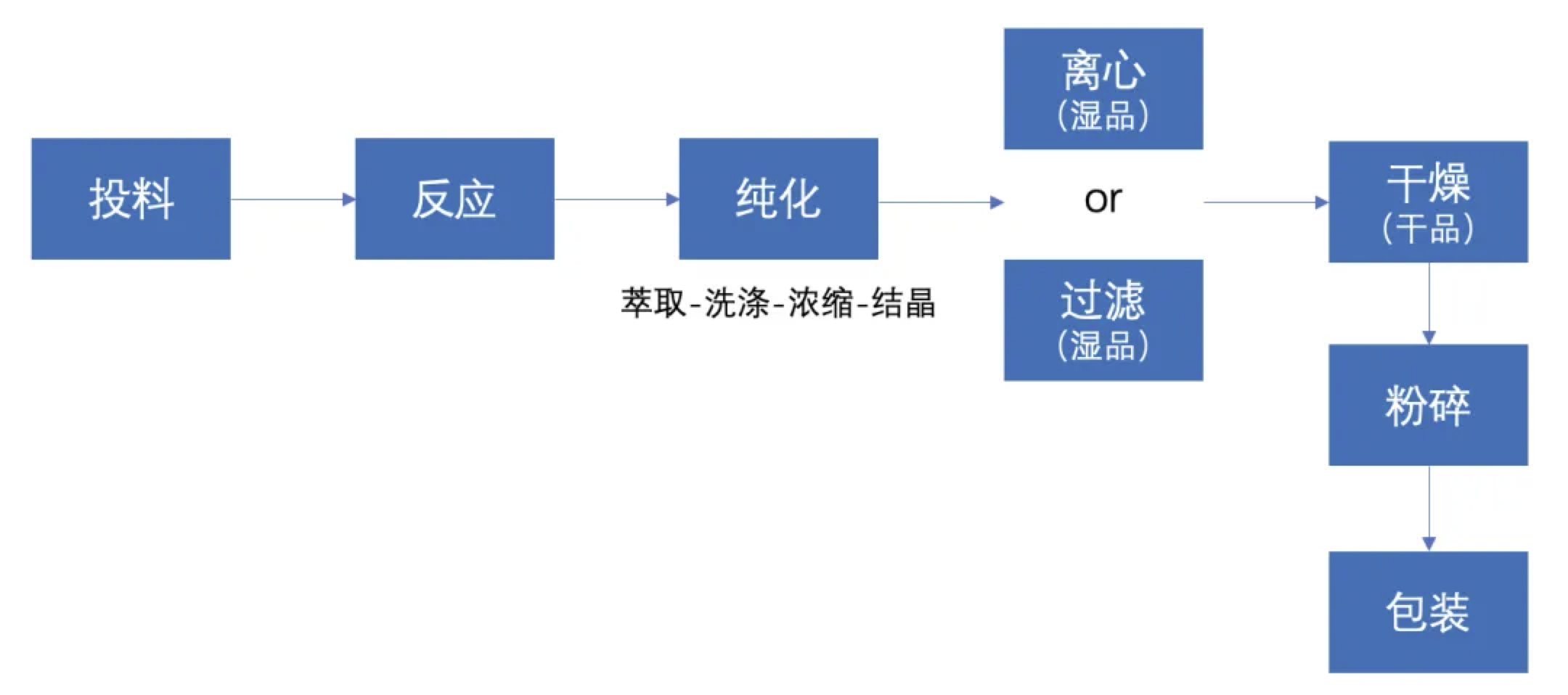
每个工序都对最终产品的质量起着至关重要的作用,但生产日期的确定需要结合法规要求和实际操作中的关键节点。
03 法规指南规定
对于制剂来说,中国GMP 2010第一百八十六条明确规定,生产日期不得迟于产品成型或灌装(封)前经最后混合的操作开始日期,不得以产品包装日期作为生产日期。
但对于原料药来说,法规没有明确提到适用的条款。我们从相关的法规指南的核心内容展开深入的研究。
GMP法规
① 中国GMP 2010 
② ICH Q7原料药的药品生产质量管理规范指南 
专家: 在API生产日期的定义上,ICH Q7指南并未对“生产日期”作出明确界定,而中国药品GMP也仅提出“生产日期不得迟于产品成型或灌封前最后混合的操作开始日期”。因此,如何定义“产品成型”仍然是当前讨论的焦点。
③ 中国药品GMP指南2023版 
专家 本指南中未直接提及原料药生产日期的制定方法,但在法规引用方向,还是选择药品GMP 2010作为背景参考。
行业指南
APIC GMPs for APIs: “How to do” Document (Interpretation of the ICH Q7) Guide Version 16

专家 在11.40的指导中,明确提到了应有程序规定如何定义生产日期,并推荐以最终纯化步骤作为API的生产日期。这一规定为生产日期的制定提供了明确的操作指引。
官方问答
① 2010年版GMP疑难问題解答/国家食品药品监督管理局高级研修学院组织编写(NMPAIED) 
并且给出了理由: 
专家: 书籍中给出了与APIC相同的观点,并进一步明确了具体的操作步骤,指出将最后一步精制工序的开始日期(即投料日期)作为原料药(API)生产日期的确定依据。
② CFDI问答: 
专家: CFDI对于原料药的生产日期则定义为不得晚于精制日期。
04 总结
① 在制定生产日期时,如何用法规索引?
虽然国外对生产日期没有明确的定义,但国内可索引药品GMP2010对生产日期的定义(官方在药品GMP2023指南参考及相关书籍和问答中都使用本法规进行了引用)。
② 如何评估API生产日期?
a) 根据上述NMPAIED法规的相关解释,活性成分(API)在生产过程中会带有大量杂质,需要通过一步或多步精制才能达到原料药的基本质量指标(如晶型、纯度、残留等)。 b) 根据上述CFDI法规的指导,产品有效期的确定基于产品关键质量属性的变化程度。因此,实际工作中,企业可根据产品关键质量属性形成的时间为标准。
③ 产品的生产日期应以什么工序来制定?
结合上述APIC和NMPAIED以及CFDI相关法规指南的分析,我们建议原料药的生产日期应不得晚于最后一步精制或纯化日期。这是因为最后一步精制或纯化工序是确保原料药达到关键质量属性的关键步骤,也是确定产品有效期和质量稳定性的重要节点。
P.S. 本文章为gempex德恩咨询原创。如需转载,请注明来源于gempex德恩咨询。
|  |手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033
|手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033