欢迎您注册蒲公英
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
你是否遇到以下情况 1. 国内外GMP现场检查 Coming Soon…
But: - 无法准确判断现有体系是否存在缺陷、是否满足法规监管的要求
- 知道存在的差距,但是不清楚具体差距有多大以及如何进行整改
2. 进入新市场… But: - 不了解当地法规是否有特殊的要求,
- 不清楚如何进行现有体系的优化……
3. 提升企业竞争力,适应未来新客户… 对于上述情况,或许您有过不同的深切体会,或者您即将面临这样的情况。
如下,德恩分享今年2月份对山东一家股份制药公司执行的一则差距分析项目(涵盖原料药和制剂范围),来了解差距分析的执行流程。以便帮助更多的企业了解项目开始前需要做的工作和执行方的工作流程,便于企业及时掌握自身的情况制定策略,实现真正意义上的节省项目时间及节约企业成本,避免无效的重复工作。
案例解析 山东某制药企业委托德恩中国团队对其企业进行全面的GMP符合性检查发现其问题与不足,以便企业明确整改内容并能在整改实施后符合欧盟、美国GMP的要求。德恩团队准备和执行如下:
1. 确定检查范围,明确产品信息 德恩与企业沟通,产品信息以及确定检查范围,检查目标等信息。 该项目,需要全面分析整个质量管理体系,包含但不限于:研发质量管理体系,原料药及制剂研发部分(技术转移、方法转移、方法验证);生产质量管理体系;原料药生产;制剂生产;实验室质量控制;污染与交叉污染;数据完整性;厂房设施及设备;工艺理解及工艺类验证;物料管理;标签及包装等,各个模块的GMP符合性进行分析。
2. 执行流程 - 执行前准备工作
德恩将在现场检查至少提前4周,提供一份清单收集信息和文件理解企业现状。 - 制定分析日程
谁在什么时间负责什么内容和板块。 - 现场执行
根据日程计划。从物料进到产品出的各个环节的硬件设施设备、管理体系、文件记录、现场状况、人员资质、环境及监控等进行全面的检查。 - 初步汇报
现场执行后,将在5个工作日内,汇报检查整体情况。该汇报将关键问题指出,并分析这些问题发生的潜在原因和改善的策略,以便企业在整体合规性方向上提高一个更好地理解。 - 最终报告
德恩将在20个工作日内,完成检查报告以及检查发现项详细清单包括建议。
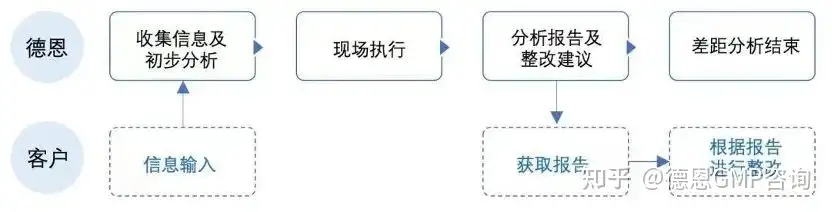
图1 德恩GMP差距分析流程图您将获得:细致深入和全面的合规性分析诊断报告,将企业各个环节可能存在的问题进行呈现并归类,分析潜在的原因,并提供落地的解决思路和方法。
德恩近期差距分析案例(节选) 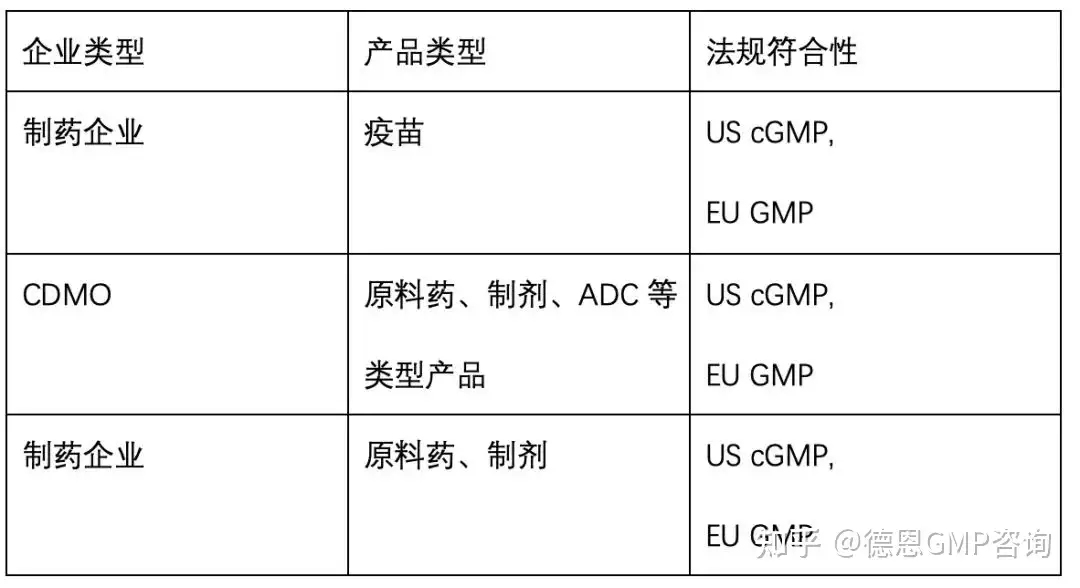
表1 德恩近期差距分析案例(节选)关于德恩差距分析详细的内容,大家可点击下面的链接,回看内容。详细了解差距分析的准备、如何做差距分析以及发现项的整改程度: 一文读懂GMP差距分析全过程
END
|  |手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033
|手机版|蒲公英|ouryao|蒲公英
( 京ICP备14042168号-1 ) 增值电信业务经营许可证编号:京B2-20243455 互联网药品信息服务资格证书编号:(京)-非经营性-2024-0033